
| 机制 | |
| 导致肌肉萎缩和无力的因素 | |
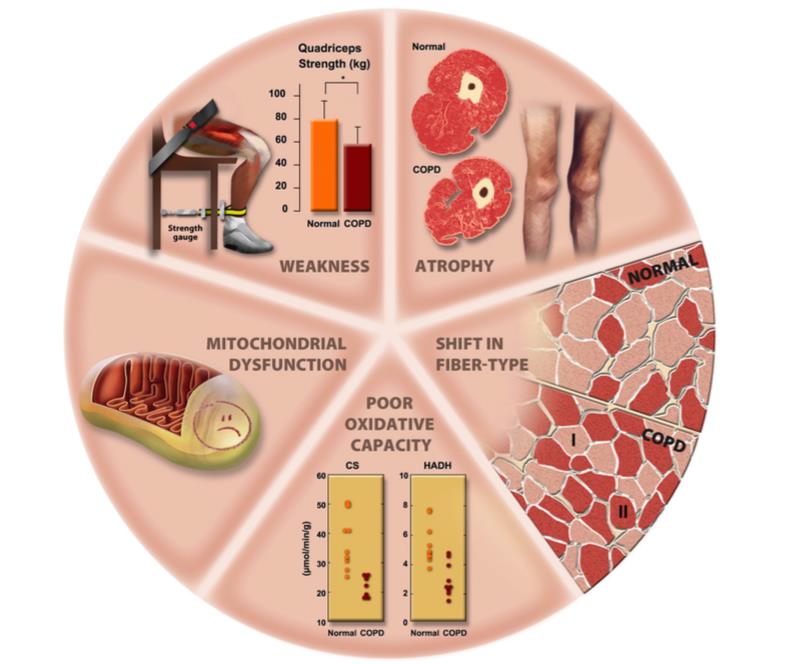
| 废用性肌肉萎缩 | 与肌肉无力、萎缩、纤维类型分布的改变和代谢改变相关 |
| 炎症 | 触发肌肉蛋白水解级联反应 |
| 氧化应激 | 触发肌肉蛋白水解级联反应; 与肌肉耐力下降相关; 蛋白质羰基化可导致运动不耐受和肌肉无力 |
| 低氧血症 | 肌肉蛋白合成减少; 通过缺氧诱导因子/von Hippel-Lindau信号级联激活肌肉降解 |
| 高碳酸血症 | 细胞内酸中毒/收缩蛋白合成或降解的变化 |
| 同化激素和生长因子水平低 | 与肌肉蛋白的合成减少相关 |
| 能量平衡受损 | 与肌肉蛋白的合成减少相关 |
| 皮质类固醇 | 通过增加肌肉生长抑制素水平和降低胰岛素样生长因子-1的水平,减少肌肉蛋白合成并促进蛋白水解 |
| 缺乏维生素-D | 导致肌无力,II型萎缩可损害钙代谢 |
| 导致肌肉易疲劳的因素 | |
| 中枢疲劳-四肢肌肉的传入反馈 | 对收缩肌肉的中枢驱动下降 |
| 氧气输送减少(心输出量减少,呼吸和四肢肌肉之间的血流竞争,毛细管作用降低) | 肌肉代谢改变,糖酵解更多; 肌肉代谢物堆积导致肌肉疲劳 |
| 肌肉代谢改变(氧化酶活性下降,线粒体功能降低) | 肌肉代谢改变,糖酵解更多; 肌肉代谢物堆积导致肌肉疲劳 |
| 研究 | 合理临界值 | 男性(kg/m2) | 女性(kg/m2) |
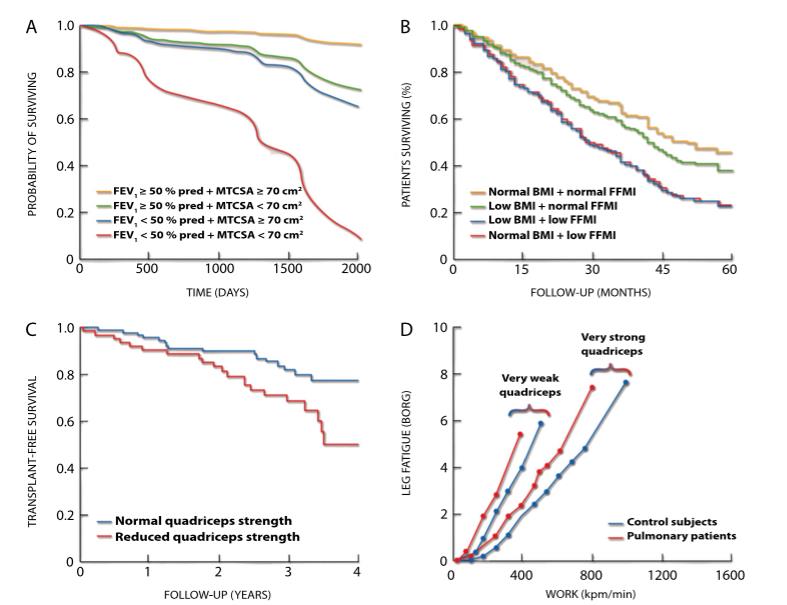
| Schols et al. | 根据大都会人寿保险公司的表格,FFM<理想体重的90% | <16 | <15 |
| Vestbo et al. | 哥本哈根心脏研究应用的FFM值的第10百分位数 | <17.1 | <14.6 |
| Coin et al. | 60-69岁人群FFM值的第10百分位数 | <17.8 | <14.6 |
| 治疗 | 肌肉质量 | 肌力 | 运动耐量 | 生存率 |
| 运动训练 | √ | √ | √ | ? |
| 氧疗 | ? | ? | √ | √ |
| 营养支持 | No | No | No | ? |
| 营养支持+运动训练 | √ | √ | √ | ? |
| 营养支持+运动训练和补充合成激素 | √ | √ | √ | ? |
| 睾酮 | √ | √ | No | ? |
| 生长激素 | √ | No | No | ? |
| 生长素 | ? | ? | ? | ? |
| 甲地孕酮 | ? | ? | No | ? |
| 肌酸 | ? | ? | No | ? |
| 抗氧化剂 | ? | ? | ? | ? |
| 维生素D | ? | ? | ? | ? |
| 维生素D+运动训练 | ? | ? | ? | ? |