脱机失败的ABC – 一种系统化方法
摘要:
有创机械通气患者中约20%~30%的患者会出现脱机困难。脱机困难的病理生理原因复杂,本篇综述提出一种系统化方法,用以判断其原因,提供诊疗思路。因为更早期地识别脱机困难的原因,或许可以加速机械通气的脱机过程。
背景
脱机失败目前定义为:自主呼吸试验失败或者气管插管拔管后48小时内再次插管。因为拔管后窘迫和再插管的风险较大,临床医师多采取两步法进行拔管前诊断流程。首先,通过各种脱机参数进行评估,这些参数包括:浅快呼吸指数、最大吸气压等;其次,采取不同的脱机技术进行脱机流程,具体方法包括:控制通气频率递减法、支持压力递减法、T管自主呼吸法等。这些方法各有利弊,目前尚无证据支持何种方法更优越,深入讨论这些方法不是本综述的主题。
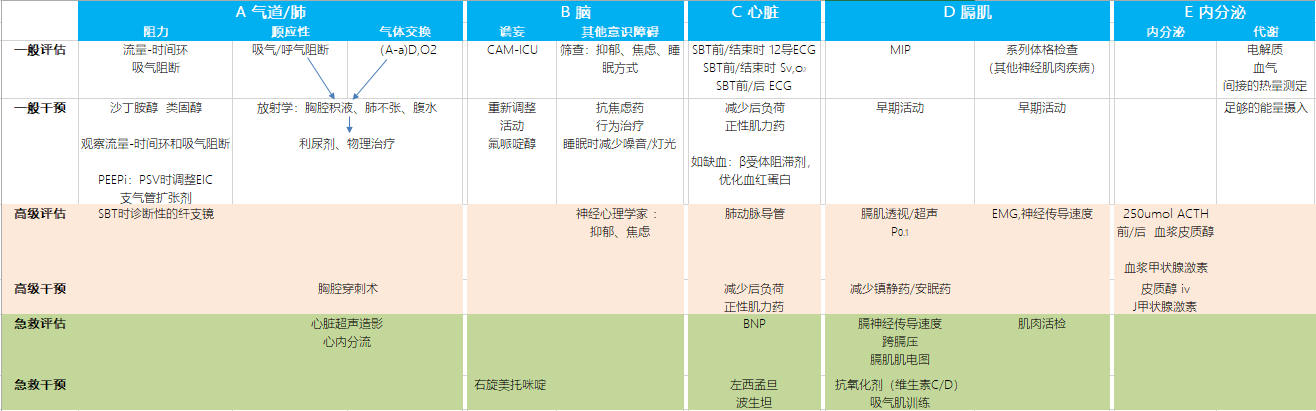
脱机困难的病理生理学机制复杂,并且通常是多因素的。以往的观点多针对单一因素,因此对临床的帮助有限。本文提出一种类似于创伤救治中“ABC途径”的系统化方法,但是我们的“脱机ABC途径”并不强调特别的顺序,只是提醒临床医师需系统化评估脱机失败可能的原因。具体包括:气道和肺功能障碍、脑功能障碍、心功能障碍、膈肌功能障碍以及内分泌代谢功能障碍。具体方案见Figure 1。
气道和肺功能障碍(Airway and lung dysfunction)
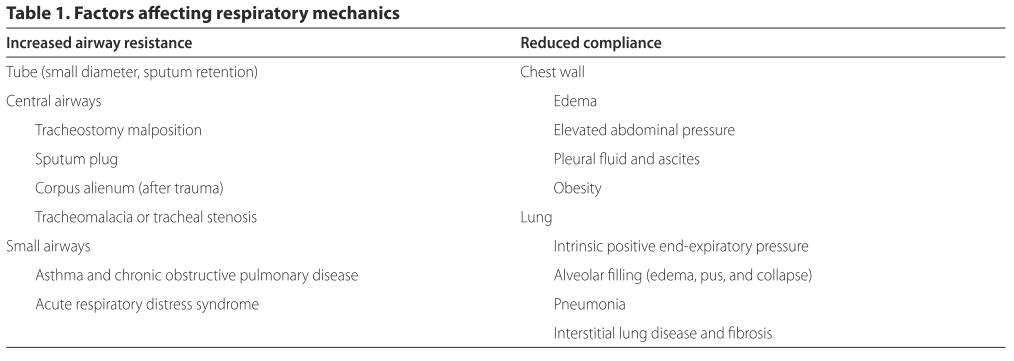
气道阻力增加、呼吸系统顺应性降低、气体交换受损均可以增加呼吸做功,从而导致脱机失败。常见的力学原因见Table 1。
1.气道阻力增加
1) 原因:
i. 上气道阻力增加:上气道阻力增加包括气道损伤(狭窄、软化、肉芽组织增生),以及人工管路本身产生的阻力。有一个被普遍接受的错误观点需要注意,即拔管后上气道阻力会降低。事实上研究发现,机械通气±5.5天患者的呼吸做功在拔管后会增加,可能的原因是上气道水肿。
ii.小气道阻力增加:Jubran和Tobin发现,自主呼吸试验(spontaneous-breathing trial ,SBT)失败的COPD患者,SBT时气道阻力显著增加(9±2cm H2O 上升到15±2cm H2O,P<0.05)。不仅COPD和哮喘患者,ARDS患者的气道阻力也会因支气管水肿而增加。
iii.内源性PEEP增加:内源性PEEP(intrinsic positive end-expiratory pressure, PEEPi)会因为气流阻力增加、呼气气流受限、高呼吸频率、肺弹性回缩受损等原因而增加。在呼吸周期中,需克服PEEPi才会产生吸气气流,因此PEEPi升高会导致呼吸做功增加。高PEEPi导致肺过度膨胀,使得膈肌不能处于长度-张力曲线中的最佳位置,影响吸气负压产生。此外,PEEPi常伴随人机不协调和无效触发,尤其是无效触发。De Wit等研究发现,无效触发增多(>10%所有呼吸)的患者,机械通气时间更长。
2)诊断方法:
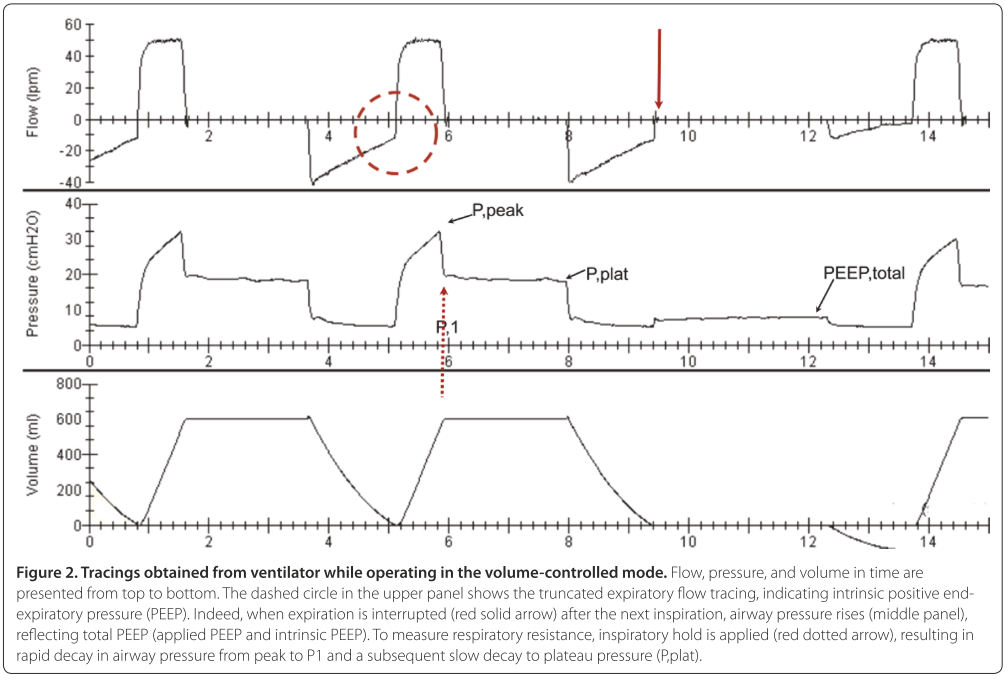
诊断的金标准是纤维支气管镜。评估气道软化程度时,需在纤支镜下断开呼吸机连接。呼吸机上流量-时间或压力-时间环可以定性评估气道阻力和PEEPi的增加。方波通气时,气道阻力可以通过以下公式计算:气道阻力=(气道峰压 — 气道平台压)/气流速,正常值<5cmH2O/L·S。PEEPi可以通过实际测得的总PEEP(呼气末平台压)减去呼吸机设置PEEP计算出,但是对于自主呼吸试验患者,只能通过测量食道压得出。见 Figure 2。
3)治疗策略:
对于COPD患者,合理地设置吸气终止标准,对于限制PEEPi和减少呼吸做功十分重要。将吸气终止从5%提高到40%,可以显著降低PEEPi和呼吸做功,尤其是对于低水平压力支持通气。通过呼气保持方法评估,设置PEEP匹配PEEPi,也可以减少呼吸做功。
需要注意吸入性支气管扩张剂是否有效作用于患者。临床研究显示,4剂沙丁胺醇100μg计量吸入后,COPD患者支气管扩张效果不再增加。400μg沙丁胺醇可以持续至少60分钟。尽管长效制剂沙美特罗可以持续更长时间,但起效时间至少30分钟,不适用于急性期。
2.顺应性降低
呼吸系统顺应性由胸壁和肺顺应性组成。ARDS患者中,脱机失败时的顺应性显著低于成功脱机。静态顺应性可以测量吸气、呼气平台压和潮气量后(见 Figure 2),通过以下公式计算得出:呼吸系统顺应性=潮气量/(吸气末平台压 — 呼气末平台压),正常值为60~100ml/cmH2O。优化顺应性的措施包括:减少肺和胸壁水肿、治疗肺不张、胸腹水引流等。
3.气体交换受损
多数患者在脱机时仍然存在明显的换气功能紊乱,导致SBT时出现低氧血症、高碳酸血症或两者皆存在。由于呼吸肌无力、呼吸力学改变等原因,脱机失败的患者不能因PaCO2升高增加分钟通气量。对此类患者,重要的是尽可能减少器械性死腔(如呼吸机管路中的湿热交换器)。
脑功能障碍(Brain dysfunction)
1.原因:
脱机困难患者相关的脑功能障碍包括谵妄、抑郁、睡眠节律紊乱等。目前仅有一篇文章专门研究谵妄在脱机中的影响,结果显示,认知功能障碍者拔管失败的风险升高四倍。
2.诊断方法:
ICU患者意识模糊评估量表(The confusion assessment method for ICU, CAM-ICU)是可靠的筛查工具。此外,目前认为咪达唑仑是谵妄发生的危险因素之一。最近的多中心试验显示,右美托咪啶与咪达唑仑相比,可以减少谵妄发生率和机械通气时间。
3.治疗策略:
包括减少镇静药物用量、每日间断唤醒和SBT(条件允许下)。长期脱机失败可能伴随抑郁,初步数据提示,药物治疗抑郁或可有利于脱机。夜间限制灯光和噪音来改善睡眠,适当的镇痛。
心功能障碍(Cardiac dysfunction)
当患者由机械通气过渡到自主呼吸时,由于胸腔内压的改变,会影响心室前后负荷和呼吸肌氧耗,从而导致心血管系统负荷增加。
1.脱机时的心功能:
研究已发现,无基础心脏疾病的COPD患者(FEV1 1.0±0.2L),脱机过程伴随着左室射血分数的显著下降(机械通气时54% ± 12% vs 自主呼吸时47% ± 13%, P <0.01),由于没有发现心肌缺血的证据,该研究者认为脱机后左室后负荷的增加,可能是其主要原因。此外,对于有基础心脏疾病的COPD患者,SBT使肺动脉阻塞压和左室舒张末期压增加,导致心室顺应性降低,进而可能导致肺、支气管壁水肿和呼吸做功增加。
在一组脱机失败的异质性患者中,可以发现混合静脉血氧饱和度(ScvO2)呈进行性下降,同时可以观察到左室和右室后负荷的增加。ScvO2的降低可能与心脏不能提高心输出量来应对脱机,从而导致氧输送降低。
脑钠尿肽(brain natriuretcic peptide, BNP)是心肌受牵张刺激而释放的一种激素。在脱机失败和拔管失败的患者中,BNP的改变显著高于成功拔管者。BNP的这种改变也支持了心功能衰竭对困难脱机患者的影响。
2.诊断方法:
当考虑脱机失败的原因是心功能障碍时,首先需要排除心肌缺血,然后可以通过SVO2进行心功能障碍的筛查。需要注意的是,SVO2降低是运动负荷增加时的正常反应,健康人中等程度运动时,SVO2会有小于50%的降低。因此,脱机失败时不伴有SVO2降低,心功能衰竭的可能性很低,此时需注意潮气量低、自主呼吸弱或意识障碍等其它原因。但当SVO2降低时,需要进一步的检查,如肺动脉阻塞压、Swan-Ganz导管、心脏超声等。
3.治疗策略:
当困难脱机患者具有心功能衰竭证据时,必须考虑减少心脏后负荷和使用强心药作为最终措施。需要注意的是,改善肺呼吸力学可能会降低左心室后负荷。新型强心药左西孟旦(一种钙增敏剂)或许可以改善困难脱机患者心功能,从而促进脱机。
膈肌/呼吸肌功能(Diaphragm/respiratory muscle function)
当开始自主脱机试验后,吸气肌的负荷急性增加。如果呼吸肌无力,会导致呼吸泵功能障碍。需要注意的是,从输入的化学感受器到收缩蛋白,任何一个部位的损伤都可能发生。
1.原因:
膈肌/呼吸肌功能障碍的原因包括驱动降低、无力、疲劳。首先,尽管多数脱机困难患者的呼吸驱动增加,但仍有部分患者的膈肌功能障碍源自膈神经损伤。膈神经损伤常见的原因是危重症多发性神经病,活检提示常伴随有危重症肌病。其次,ICU获得性衰弱(ICU – acquired weakness)目前逐渐受到重视。机械通气患者的呼吸肌收缩功能损伤,目前已有充分的证据证实。研究发现,长期机械通气患者(±29天),磁刺激膈神经产生的跨膈压仅为健康人的35%。此外,尽管目前对ICU患者存在呼吸肌无力已无争议,但是对于脱机失败患者是否存在肌肉疲劳,仍有不同观点。Laghi等评估了脱机失败前和30分钟后的膈肌力量,令人惊讶的是,患者未见吸气肌疲劳。可能的解释包括:脱机失败后很快恢复了机械通气、辅助吸气肌的参与,或者在脱机试验结束30分钟内呼吸肌疲劳已恢复。
2.诊断方法:
诊断膈肌功能障碍是非常复杂的过程。目前,对于机械通气或自主呼吸患者,评估呼吸驱动最常用的指标是100毫秒气道闭合压(airway occlusion pressure at 100ms, P0.1)。正常值为0.5~1.5cmH2O。需要注意的是,P0.1不仅仅与呼吸驱动有关,也反映吸气肌能力。因此,P0.1的减少,并不一定是呼吸驱动降低,但是如果患者具有正常/升高的P0.1,则损伤原因不太可能是呼吸驱动。
最大吸气压(MIP)可用于评估总体的呼吸肌功能。<65岁的健康人群中,男性MIP最低值为-75cmH2O,女性为-50 cmH2O。由于受到患者配合程度、肺容量等影响,MIP的阳性预测值不高,但具有很好的阴性预测值,即产生更大的负压时可以排除吸气肌无力。同时,由于不能评估患者吸气肌的耐力,因此MIP作为脱机预测指标时,仍存在争议。
自主呼吸试验后,明确诊断呼吸肌疲劳,在临床操作上难以执行。即使发展为高碳酸血症也不是呼吸肌疲劳的特异性表现,因为中枢性高碳酸血症、浅快呼吸节律也可以导致上述情况。同样,脱机失败时不伴有高碳酸血症,可以排除吸气肌疲劳。
3.治疗策略:
对于呼吸肌来说,机械通气是把双刃剑。呼吸肌去负荷后,会缓解膈肌疲劳,但是也会导致废用性膈肌无力。目前关于吸气肌训练对肌肉力量和通气时间等临床预后指标的研究仍较少。一项小样本的非对照观察性研究发现,吸气肌训练可以增加吸气压力(从研究开始时7 ± 3 cmH2O,升高到脱机时18 ± 7 cmH2O)。需要注意的是,膈肌收缩通常是在低于最大收缩力的水平下进行的,因此吸气肌训练策略的重点应该是膈肌耐力。此外,其它需要进一步研究的治疗方向包括:抗氧化剂、强化胰岛素治疗、生长激素治疗。
内分泌和代谢功能障碍(Endocrine and metabolic dysfunction)
目前有少数文献研究了内分泌紊乱对困难脱机的作用。Huang等发现,93例选择性困难脱机患者中,70例患者符合肾上腺皮质功能不全诊断。这些患者在补充皮质醇后,脱机时间比安慰剂对照组更短(3.4±2.3天 vs 6.5±4.7天,P<0.05),尽管其中的病理生理机制尚未明确。在另一项观察性研究中,3%的延长脱机患者(4/140)存在新发甲状腺机能减退。在补充治疗后,其中3例患者成功脱机。虽然缺乏对照试验,但是对于脱机失败患者,考虑甲状腺机能减退诊断是否存在是合理的。
营养不良会导致肌肉质量下降,从而导致困难脱机。可以通过测量体重指数(body mass index, BMI)、血浆白蛋白浓度、氮平衡,甚至理想状态下卡路里计量器来评估营养状态。电解质紊乱方面,目前已证明血磷和血镁可以影响骨骼肌功能,但由于没有针对脱机失败的研究,这方面的作用仍待进一步明确。其它可能影响脱机的代谢紊乱还包括:代谢性酸中毒、发热。
结论
综上所述,脱机失败的原因多种多样。系统化评估脱机失败的原因,有助于辨别病人的具体原因。同时需要注意,这种“ABC”系统化方法还有待完善,因为我们对脱机失败的认识亦远远不够。
参考文献:Heunks LM,Van Der Hoeven, JG. Clinical review: The ABC of weaning failure - a structured approach. Critical Care. 2010, 14: 245.