要点:
肢体和呼吸肌无力在危重症病人中极为常见。
呼吸肌无力可增加机械通气时间,易引起医源性并发症(包括肢体肌无力)和死亡。
转出ICU后,肢体肌无力仍将持续数月,导致长期的功能状态和生活质量低下。
肌肉损伤的主要机制包括危重症多发性神经肌病、脓毒症、药物、代谢紊乱和肌肉过度负荷及去负荷。
膈肌无力源自呼吸机支持不当导致的过度去负荷(导致萎缩)或过度负荷(向心或离心)。
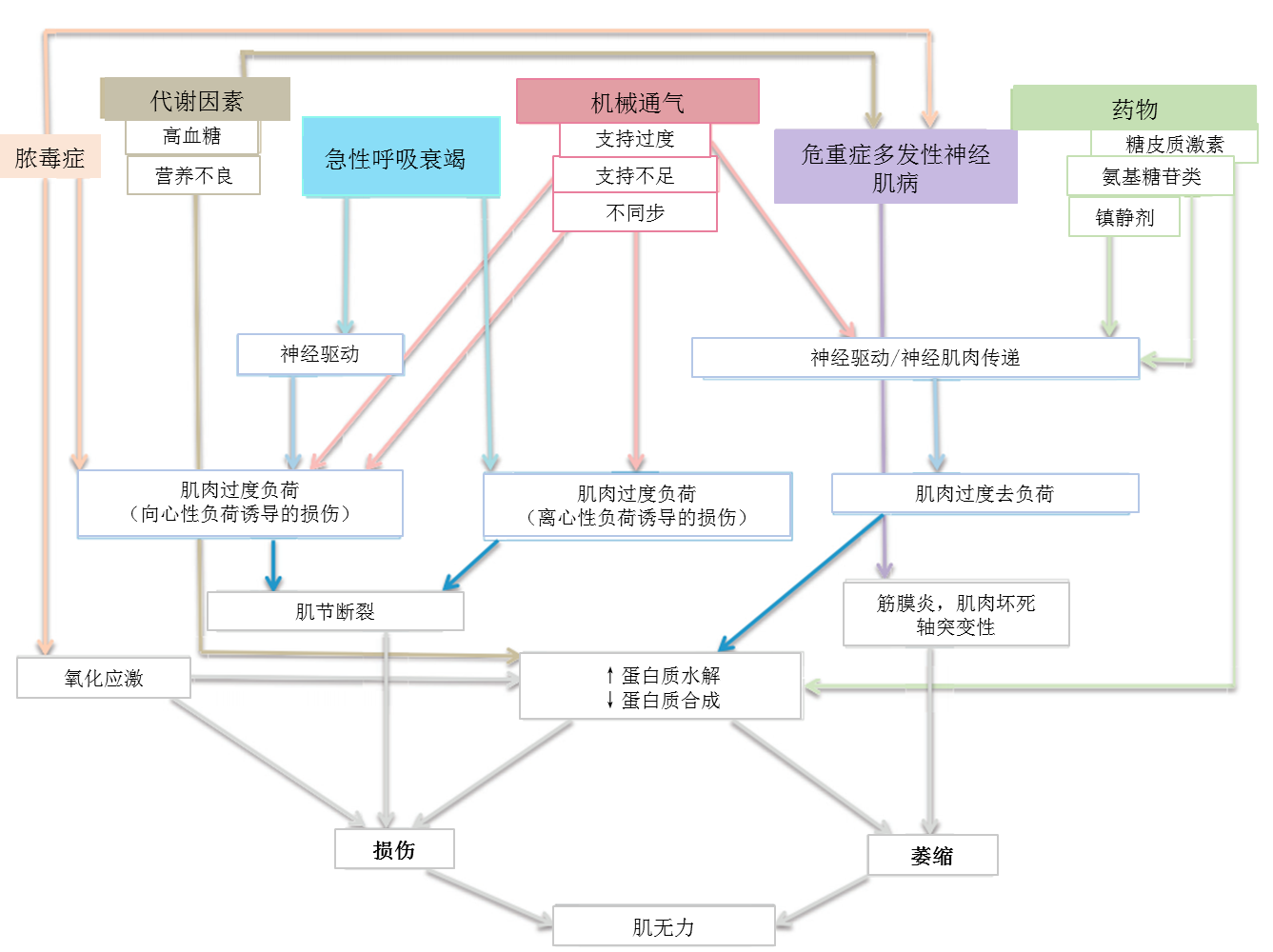
危重症时肌肉损伤和肌无力的机制
在危重症情况下,有多种因素可导致肌肉损伤和肌无力。我们对这些因素进行了总结,并重点关注可作为潜在干预目标的机制。这些机制如图3所示。
图3 机械通气对肢体肌肉和呼吸肌的损伤机制。详情见正文。
危重症多发性神经肌病
20世纪80年代,博尔顿和他的同事首次描述了危重症多发性神经肌病,该疾病现已被广泛认为是ICU获得性肌无力(肢体肌肉和呼吸肌都受影响)的一个重要原因。这种疾病的神经病变特点是非脱髓鞘的轴突变性,而肌肉病变是以萎缩、筋膜炎和肌肉坏死为特征。患者可能表现为神经病或肌病,或两者皆有,且多器官功能衰竭的患者尤其易受影响。神经和肌肉损伤可能是多种机制的下游效应,包括过度去负荷、脓毒症、全身炎症反应、微血管缺血和代谢紊乱(尤其是高血糖)。因此,我们将更详细地探讨每一种具体的机制。
肌肉过度去负荷
长期不活动和卧床对肌肉结构和功能的有害影响早已得到公认。由于镇静、瘫痪和机械通气支持的作用,危重患者通常会有一段时间处于肌肉完全去负荷的状态。肢体肌肉萎缩和膈肌萎缩都是这种去负荷的并发症。重要的是认识到肌肉萎缩并不是不活动本身的结果,而是由于肌纤维产生的张力(即肌肉负荷)减少导致的。
肌肉去负荷通过上调蛋白水解系统和下调蛋白合成系统,进而导致肢体肌肉和呼吸肌萎缩。有趣的是,肌纤维的机械力如何转化为生物信号目前尚不可知;一些证据表明,肌纤维中的主要结构蛋白——肌联蛋白,可能是一种力学传感器。对动物模型和脑死亡器官供体的观察表明,膈肌线粒体功能障碍可能引发氧化应激和蛋白水解,不过最近的一项研究发现,没有证据证明在早期的机械通气过程中,萎缩的膈肌组织中存在线粒体功能障碍。
1. 膈肌萎缩
如果机械通气过度去负荷导致压力和流速过大,会迅速发展成膈肌萎缩和无力。一系列动物模型的实验研究表明,在控制通气和/或压力支持下(高水平的辅助下),膈肌去负荷迅速导致膈肌萎缩、肌纤维损伤和肌无力。
膈肌废用性萎缩已在临床得到广泛的证实。从脑死亡器官供者和机械通气患者处获得的膈肌组织标本,显示出与动物模型相似的萎缩和损伤模式。超声和计算机断层扫描等影像学研究也显示了随时间推移发展的进行性萎缩。一些患者膈肌厚度可能在3天内减少30%-40%。萎缩率与膈肌超声显像评估的膈肌负荷水平(吸气努力)成反比。这些形态学变化在临床意义重大:膈肌厚度的减少与膈肌功能受损相关,也与延长机械通气、再插管和气管切开术风险增加有关。
2. 肢体肌肉萎缩
由于危重症患者长期不活动,肢体肌肉经常长时间完全去负荷;然而,肢体肌肉萎缩比膈肌萎缩发展得更慢。Puthucheary和同事使用连续超声成像发现,股直肌横截面积在机械通气的第一周下降了约10%。有更多器官衰竭的病人萎缩得更快。萎缩程度、蛋白合成与分解平衡,与全身炎症严重程度相关;该研究没有测量运动水平,但作者推测,运动水平的差异不太可能解释萎缩率的变化。一般来说,危重症患者的肌肉消耗程度会高于预期的肌肉完全去负荷所消耗的程度,提示了导致净蛋白损失的额外因素的重要性。
在危重症幸存者的队列研究中,所有患者在ICU出院7天后均出现四头肌萎缩。在接下来的几个月内,不同患者的肌肉再生情况有很大差异,但大多数患者在ICU出院6个月后仍存在萎缩。有趣的是,那些恢复了肌肉量的病人仍然非常虚弱,而这种虚弱的机制尚不清楚。
肌肉过度负荷
虽然肌肉废用的危害已成为共识,但肌肉过度负荷的不良影响却尚未得到足够的重视。事实上,越来越多的证据表明,过量的负荷可能会导致临床显著性的呼吸肌损伤。过度负荷分为两种形式:向心性和离心性。
1. 向心性负荷诱导的损伤
当肌肉收缩时,这种在肌肉内的缩短作用产生高强度的伤害性张力,造成同心负荷诱导的损伤。持续的高吸气阻力负荷会导致明显的膈肌损伤、炎症和肌无力。受伤的膈肌表现为肌节断裂和肌纤维对钙蛋白酶介导的降解敏感化。
虽然人体负荷诱导的膈肌损伤阈值通常较高,但危重患者可能更容易发生负荷诱导的膈肌损伤,这是因为全身炎症使肌膜变得脆弱,更容易受到机械应力的损伤。在脓毒症的动物模型中也得到了证实,与自主呼吸相比,机械通气时膈肌不活动可以防止肌膜损伤和膈肌无力
急性和慢性过度阻力负荷均可导致人体膈肌损伤。机械通气患者膈肌活检标本显示明显的炎症浸润和肌节排列紊乱,这与负荷诱导损伤模型相似。因高呼吸驱动、呼吸机支持不足和人机不同步而导致频繁出现高呼吸努力,使得危重症机械通气患者发生负荷诱导膈肌损伤的风险更高。
最近的观察表明,一些机械通气患者在早期通气过程中,随着吸气量的增加,膈肌厚度迅速增加,这在很大程度上帮助证实膈肌过度负荷的不良影响。出现这种厚度增加的患者往往膈肌功能受损,更有可能需要长时间的机械通气,膈肌厚度的增加为负荷引起肌肉损伤的可能性提供了支持。负荷损伤后肱二头肌横截面积明显增大;目前还不清楚膈肌是否也是如此.
2. 离心性负荷诱导的损伤
肌肉伸长时的离心收缩比肌肉缩短时的同心收缩更具危害性。在一定的压力产生水平下,离心收缩会增加施加在肌肉上的张力。在一个实验模型中,离心性负荷会引起严重的急性膈肌损伤
正常受试者在静息潮气通气时,一般表现出较低水平的离心收缩。在与危重症有关的几种情况下,可能会发生更剧烈的离心收缩。首先,当呼吸机械负荷增加时,呼气时膈肌收缩活动(“呼气制动”)可减轻肺不张的恶化。其次,在某些形式的人机不同步时,膈肌可能会离心收缩,导致病人在呼气相的吸气努力,此时肺容积正在减少,膈肌正在伸长。不同步的形式包括无效努力——病人无法触发呼吸机;反向触发——被动机械充气引起的神经性吸气,经常引致机械性通气。
脓毒症
感染是机械通气患者发生明显膈肌无力的主要危险因素。与没有脓毒症的患者相比,脓毒症患者的膈肌肌力降低了约50%。与脓毒症相关的肌无力是由促炎细胞因子、氧化应激和蛋白水解途径激活介导的。脓毒症还会破坏细胞水平的氧气输送和使用,导致代谢紊乱和收缩功能障碍。如前所述,脓毒症增加了肌膜的脆性,增加了对负荷损伤效应的敏感性。在这方面,脓毒症相关的卧床和暂时制动可能构成对全身感染的适应性(而非非适应性)反应。
药物
许多用于治疗危重病人的药物都会有肌病的临床表现。镇静剂可通过促进休息和废用性萎缩而产生直接和间接的不良影响。异丙酚剂量相关地引起膈肌收缩力下降。神经肌肉阻滞剂也可能导致废用和随之而来的萎缩。值得注意的是,氨基甾体类肌松药(如罗库溴铵) 具有比苄基异喹啉类代表肌松药(如顺阿曲库铵)更强的肌病作用,这可能是其糖皮质激素样影响作用于细胞内钙稳态和蛋白水解的结果。在一项最大的对机械通气的急性呼吸窘迫综合征患者应用神经肌肉阻断剂(顺阿曲库铵)的随机试验中,这类效应可能导致肢体肌肉无力方面无任何差异。
众所周知,糖皮质激素是引起骨骼肌肌病(包括呼吸肌和周围肌)的原因之一。糖皮质激素抑制蛋白质合成,激活蛋白质分解。然而,糖皮质激素的作用很复杂,可能在某种程度上取决于特定的药物、剂量和病人的情况。Maes和同事的报道提到,与常识相反,在控制通气期间使用高剂量甲基强的松龙可以阻止calpain的激活并抑制calpase-3,从而防止呼吸机引起的膈肌功能障碍。相比之下,低剂量甲基强的松龙的不良影响甚至比单独控制机械通气更有害。
某些抗生素可能会加重肌无力。氨基糖苷会干扰神经肌肉传递
代谢因素
与危重疾病相关的各种代谢紊乱会加剧肌无力。呼吸性酸中毒、高碳酸血症和低钾血症可导致可逆性膈肌无力,而代谢性酸中毒似乎没有影响。除此之外,高碳酸血症可以预防由呼吸机引起的膈肌功能障碍。高血糖是引起肌肉损伤的重要危险因素。长期营养不良容易导致ICU获得性肌无力,这是由于缺乏基础的肌肉蛋白质储备所导致。